
Sandra Paola Herrera Macera a; Luis Enrique Boada Rodríguez b; Welky Giuseppe Colamarco Navas c; Karla Geoconda Boada Rodríguez d
DOI: 10.26820/reciamuc/3.(1).enero.2019.377-397
URL: http://reciamuc.com/index.php/RECIAMUC/article/view/240
Código UNESCO: 3205 Medicina Interna
Tipo de Investigación: Artículo de Revisión
| Recibido: 10/12/2018 | Aceptado: 20/01/2019 | Publicado: 30/01/2019 |
| Correspondencia: director@reciamuc.com | ||
a. Médico; Guayaquil, Ecuador.
b. Médico; Guayaquil, Ecuador.
c. Médico; Guayaquil, Ecuador.
d. Médico; Guayaquil, Ecuador.
Se realizó una revisión bibliográfica consultándose 11 referencias con un gran alto de actualización y está en base de datos de prestigios, relacionada el uso de la citometria en el diagnóstico de los diferentes tipos de inmunopatias, sus principales en cuanto a tipo de estudio así como la utilidad de la misma a la hora de tomar conducta en cada caso, lo anterior se realizó con el objetivo de ampliar los conocimientos sobre el tema y mostrar a los profesionales de la salud la importancia de esta técnica así como el uso de la misma. Para ello se realizó una exhaustiva revisión de textos, búsqueda de información digitalizada entre otros. Arribándose a las siguientes conclusiones, la citometria de flujo resulta de gran importancia pues permite entre otros aspectos clasificar las inmunopatias en distintos subtipos inmunológicos, así como identificar subgrupos de mal pronóstico y detectar fenotipos aberrantes. Todo lo anterior resulta de gran utilidad para el diagnóstico de la enfermedad mínima residual que permite estratificar a los pacientes en diferentes grupos de riesgo e individualizar las disimiles modalidades de tratamiento.
Palabras Claves: Inmunopatias; Citometria de Flujo; Inmunofenotipo.
A bibliographic review was made by consulting 11 references with a high update and is based on prestigious data, related to the use of cytometry in the diagnosis of the different types of immunopathies, its main ones in terms of type of study as well as the Its usefulness when taking behavior in each case, the foregoing was done with the aim of expanding knowledge on the subject and showing health professionals the importance of this technique as well as the use of it. For this purpose, an exhaustive review of texts was carried out, as well as the search for digitized information among others. Arriving at the following conclusions, flow cytometry is of great importance since it allows, among other aspects, to classify immunopathies into different immunological subtypes, as well as to identify subgroups of poor prognosis and to detect aberrant phenotypes. All of the above is very useful for the diagnosis of minimal residual disease that allows stratifying patients in different risk groups and individualize the different treatment modalities.
Key Words: Immunopathies; Flow cytometry; Immunophenotype.
Introducción
Las inmunopatias son inmunodeficiencias primarias (IDP) que agrupan alrededor de casi 200 enfermedades de origen genético en las que existe una alteración cuantitativa y/o funcional de los diferentes mecanismos implicados en la respuesta inmunológica, constituyendo un conjunto hererogéneo de enfermedades producto de mutaciones monogénicas, en su mayoría de origen hereditario, que comprometen la homeostasis del sistema inmunológico y provocan enfermedad. El estudio de las mismas se encuentra en constante actualización para lograr la mejor caracterización inmunológica, diagnóstico, tratamiento y pronóstico de estos enfermos. (Ahmadi A, 2014).
Estas entidades originan una predisposición aumentada a infecciones sobre todo, pero también a procesos autoinmunes, alergia y cáncer. Se conoce el defecto molecular en la mayoría de ellas, aunque se siguen describiendo nuevos genes cuyas mutaciones originan inmunodeficiencia primaria, y nuevos fenotipos clínicos.
Para facilitar el diagnóstico de las mismas, la Unión Internacional de Sociedades Immunológicas (IUIS) ha elaborado la siguiente clasificación de los diferentes grupos, en función de la afectación:
Constituyen en su conjunto patologías muy frecuentes de lo que hasta ahora se creía (prevalencia de hasta 1/12001 (excluyendo el déficit de IgA, que es asintomático en la mayoría de casos), al menos tan frecuente como la fibrosis quística o la diabetes tipo I. Aunque las inmunodeficiencias secundarias son mucho más frecuentes que las primarias en el adulto, en el niño el peso de las primarias es mucho más relevante. (Ahmadi A, 2014)
Siendo pues importante la prevalencia de las IDP, el desconocimiento de las mismas por los profesionales lleva frecuentemente a infradiagnóstico o a retraso diagnóstico, con mor-bimortalidad significativa e importante impacto social y económico, evitables en gran parte al disponer actualmente de tratamientos altamente eficaces e incluso curativos (medidas de soporte, antibióticos, tratamiento sustitutivo con gammaglobulina, trasplante de progenitores hematopoyéticos). Sin embargo, es relativamente fácil sospechar IDP, en base a un conjunto de síntomas y signos que permiten identificar patrones clínicos bastante bien definidos. (Sedek L, 2014)
Las IDP combinadas presentan anormalidades en la inmunidad mediada por células (linfocitos T), en la inmunidad mediada por anticuerpos (linfocitos B) y también en la inmunidad innata con ausencia o disminución de las células natural killer (NK), células dendríticas (DC) y monocitos. Es por ello que es necesario el estudio de estos tipos celulares para definir o avanzar en el diagnóstico correcto de estas entidades. (Sedek L, 2014)
El diagnóstico de las mismas se debe empezar con una historia clínica y una exploración física, planteándose un diagnóstico diferencial, se tendrán además en cuenta los antecedentes familiares de infecciones recurrentes o atípicas, muertes precoces, autoinmunidad o cáncer, pueden contribuir a descartar la entidad. (Sedek L, 2014)
Las infecciones son la marca de la mayoría de las inmunopatias. Pueden aparecer otitis supuradas en un año (para otros, expertos cuatro otitis en un año ya constituyen una alarma), se suman además dos o más sinusitis graves en un año, la antibioterapia durante más de dos meses con poco efecto, dos o más neumonías en un año, abscesos cutáneos recurrentes, aftas persistentes después de un año de edad, necesidad de antibióticos intravenosos para infecciones habituales, dos o más infecciones de localización profunda. (Sedek L, 2014)
La realización de, un estudio inicial muy sencillo (hemograma y cuantificación de inmunoglobulinas) puede detectar hasta la mitad de las IDP. No obstante el estudio de estas entidades se debe empezar con una historia clínica y una exploración física además de un conjunto de exámenes complementarios los cuales se realizan en un orden de secuencia comenzando por determinaciones sencillas, pero de gran valor, interpretando los resultados cui-dadosamente, y repitiendo (para confirmar resultados o porque las alteraciones pueden aparecer en la evolución) o avanzando a medida que los resultados de las exploraciones previas o la sospecha clínica lo indiquen. (Sedek L, 2014)
Las determinaciones para el diagnóstico de inmunopatias se dividen en exploraciones básicas y generales, dentro de las cuales tenemos:
Si los resultados anteriores son anómalos, o si la clínica es sugestiva (a pesar de resultados normales), se pueden dar tres situaciones:
Alteración de la cifra de neutrófilos
Neutrófilos bajos (<1500/mm3): repetir recuento para confirmar neutropenia, recuentos periódicos para descartar neutropenia cíclica, descartar otras causas de neutropenia. (incluyendo neutropenia asociada a otras IDP). Considerar neutropenia congénita grave (de origen genético, CMV congénito…) frente a neutropenia autoinmune del lactante (mucho más frecuente, clínica leve, normalización de cifra de neutrófilos durante los episodios infecciosos, tendencia a resolución antes de los 3-4 años). (Biomed A, 2014)
Neutrófilos muy elevados (>20 000/mm3): considerar déficit de adhesión leucocitaria (CD 18, CD15s). Además, la morfología leucocitaria puede detectar algunos defectos de función fagocítica (Chediak-Higashi). (Biomed A, 2014)
Se realizan también estudios de anticuerpos: anticuerpos a antígenos proteicos (antitétanos, antidifteria) (mayores de 5-6 meses, vacunados), dosis de recuerdo si título basal bajo (respuesta adecuada: x4, menor si la cifra basal es elevada). Anticuerpos anti rubeola/anti sarampión Ig G (mayores de 12-15 meses vacunados). Anticuerpos naturales (isohemaglutininas antiABO, anticuerpos heterófilos…): a partir de los dos años. Anticuerpos antineumococo y control tras vacuna polisacárida (Neumo23): normal x2 o x4 (no consenso).
En vacunados con antineumocócica conjugada la interpretación puede ser difícil. La vacuna contra Salmonella es también polisacárido capsular, pero la determinación de anticuerpos anti salmonella no está aún validada para evaluar la respuesta vacunal.Anticuerpos IgG frente a otros gérmenes comunes o vacúnales (CMV, EBV, hepatitis B, ASLO). En casos dudosos, la respuesta presente a varios de ellos ayuda a descartar un déficit de anticuerpos. (leukemia, 2014)
En otras ocasiones se debe considerar el estudio de poblaciones linfocitarias como:
CD3 (linfocitos T totales), CD3 + 4 + (linfocitos T helper), CD3 + 8 + (linfocitos T citotóxicos), CD19 (linfocitos B), CD16/56 (NK). Comparar los valores para la edad y valorar cifras absolutas y relativas. La ausencia de linfocitos B es altamente sugestiva de agammaglobu-linemia congénita en niños menores de 3-4 años. Considerar hipogammaglobulinemia transitoria del lactante (buen estado general, infecciones no graves, formación de anticuerpos adecuada, lin-focitos B presentes). (leukemia, 2014)
Considerar estudio de complemento (C3, C4, CH50) si inmunoglobulinas normales e infecciones recurrentes y/o graves por gérmenes encapsulados (posible déficit de C2). (leukemia, 2014)
Teniendo en cuenta lo anterior se hace necesario el estudio del fenotipo linfocitario el cual incluye diferentes marcadores específicos de linaje en la superficie de la membrana celular, que se basa en el patrón de migración y diferenciación de cada subpoblación en el contexto del sistema inmune en el organismo. Por lo anterior, es de gran importancia conocer la cuantificación de poblaciones y subpoblaciones linfocitarias para orientar el estudio que permite profundizar en estas alteraciones y definir un diagnóstico en enfermedades que muestran un amplio polimorfismo clínico. Es decir la citometria de flujo. (Gajendra S, 2014)
Metodología.
Se realizó una revisión bibliográfica en la cual se consultaron 11 referencias bibliográficas de prestigiosas revistas que tienen un alto grado de actualización con respecto al tema y están en prestigiosas base de datos como PubMedCentral.
Desarrollo.
La citometría de flujo (CMF) constituye una técnica de avanzada, automatizada, objetiva y altamente sensible, muy útil para el estudio del inmunofenotipo de las células normales y anormales. Este procedimiento permite realizar análisis multiparamétricos del componente celular en suspensión de una manera individual, célula a célula, a través de sus características físico-químicas e identificar la expresión de proteínas celulares, lo que hace que con los procedimientos de disgregación de tejidos, como son los órganos linfoides o la piel, se pierda información sobre la localización tisular de cada una de las células presentes en la muestra. En estos casos, se recomienda emplear técnicas de inmunohistoquímica. (Gajendra S, 2014)
Estos estudios definen fenotipos celulares y aportan datos de interés funcional que permiten profundizar en el comportamiento del sistema inmunológico en estas enfermedades y su asociación con la expresión de marcadores moleculares y genéticos de interés. A continuación se explica la aplicación de estas técnicas en diferentes grupos celulares. (Gajendra S, 2014)

Células T
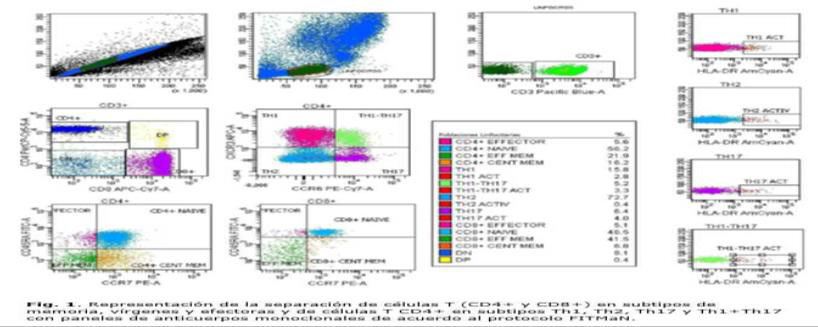
Los linfocitos T se identifican mediante su separación de los linfocitos totales utilizando el marcador característico CD3. De estos se separan los linfocitos colaboradores (CD4+) de los citotóxicos (CD8+). A partir de cada uno de ellos, utilizando los marcadores CD45RA y el receptor de quimiocina tipo 7(CCR7) se distinguen los linfocitos naive o vírgenes (CCR7+CD45RA+), los linfocitos de memoria central (CCR7+CD45RA-), los linfocitos de memoria efectora (CCR7-CD45RA-) y los linfocitos efectores (CCR7-CD45RA+). (Yu G, 2014)
La separación de los linfocitos T CD4+ y CD8+ mediante CD45RA y CD45RO permite identificar las células T de memoria (CD45RA-/CD45RO+) y las células T vírgenes y efectoras (CD45RO-/CD45RA+). En cada grupo el marcador CCR7 permite diferenciar dentro de las células de memoria (CD45RA-), las de memoria central (CCR7+)y las de memoria efectora (CCR7-); y dentro de las células T que no son de memoria (CD45RO-/CD45RA+),las células vírgenes (CCR7+) y las células efectoras (CCR7-). (Yu G, 2014)
Células T colaboradoras: Una vez separados mediante su marcador de linaje
(CD3+) y de los linfocitos citotóxicos (CD8+), los linfocitos colaboradores (CD4+)se separan en subtipos mediante la expresión o no de los receptores de quimiocinas tipo 3 (CXCR3) y 6 (CCR6) como son: Th1 (CXCR3+CCR6-) , Th2 (CXCR3-CCR6-), Th17(CXCR3-CCR6+)y Th1-Th17 (CXCR3+CCR6+).Con los marcadores de activación HLADR y CD38 se diferencia el porcentaje de células activadas de cada subclase colaboradora y citotóxica. (Yu G, 2014)
Células T reguladoras: Los linfocitos T CD4+ se separan mediante marcadores característicos (CD3+CD4+). La estrategia de enfrentar CD25 vsCD127 permite identificar las células T reguladoras (CD25+CD127low). Concretamente, serán células T reguladoras aquellas que expresen el receptor de quimiocina tipo 4 y el CD45RO (CCR4+CD45RO+) (Yu G, 2014)
Células B
Los linfocitos B se identifican mediante la caracterización (CD3-CD19+). La combinación de los marcadores IgD y CD27 permite la identificación de los linfocitos B vírgenes o naive (IgD+ CD27-), las células de memoria previas al cambio de clase, en inglés, pre-switch memory(IgD+ CD27+),las de memoria con cambio de clase, en inglés switchmemory (IgD-CD27+) y las agotadas o exhausted B cells(IgD/CD27-) . (Yu G, 2014)
A partir de las células B vírgenes se distinguen las células transicionales (CD38highCD24high), que están en un estado más inmaduro. A partir de las switch memory se pueden distinguir los plasmablastos (CD38+CD24-), que están en un estadio de maduración previo a las células plasmáticas; y utilizando los marcadores CD38 y CD20, una población que incluye plasmablastos y células plasmáticas (CD38+CD20+). (Al-Herz W, 2014)
Entre los linfocitos B, a partir de su marcador de linaje CD19, se pueden identificar:linfocitos B vírgenes(CD21+CD27-) ,de memoria (CD21+CD27+), CD21low (CD21low CD27+) e inmaduros (CD21-CD27-) mediante la combinación de CD21 vs CD27. A partir de CD21low y con los marcadores CD21 vsCD38 se puede discernir entre el activado (CD21lowCD38-) y los transicionales inmaduros. También se pueden diferenciar los linfocitos de memoria que han cambiado de clase y los que no, mediante la combinación de marcadores IgD e IgM, así como los que han pasado a plasmablastos (IgM-CD38+). Con los mismos marcadores, a partir de los linfocitos B vírgenes se identifican los linfocitos B transicionales y dentro de los linfocitos B, las células plasmáticas (CD38+CD138+). (Al-Herz W, 2014)
Células dendríticas/células NK/ MONOCITOS
Por exclusión de los linfocitos T y los linfocitos B, se hace una selección negativa de los CD3-CD19-CD20-; de esta, es que se seleccionan los monocitos y las células dendríticas y las células NK. Para diferenciar estos tipos celulares, en la misma ventana mediante la lectura de la combinación de marcaje con CD56 vs CD14 se distinguen los monocitos (CD56- CD14+) En los monocitos se puede distinguir entre los clásicos (CD14+CD16-) y los no clásicos (CD14+CD16+). En las células NK (CD56+CD16+), mediante la combinación CD56 vs CD16 es posible distinguir entre los NKsbright y los NKsdim. (Al-Herz W, 2014)
Las células dendríticas son CD56-CD14-HLA-DR+ y con la combinación del CD11c y el CD123se pueden diferenciar las células dendríticas mieloides de las plasmacitoides. (Al-Herz W, 2014)
La CMF emplea anticuerpos monoclonales (AcMo) unidos a fluorocromos, que son detectados y visualizados mediante un sistema informático apropiado y de forma rápida, permite analizar un elevado número de partículas en suspensión en un corto periodo (5 000 partículas/s); ofrecer información simultánea de varios parámetros celulares, identificar paralelamente antígenos de superficie y citoplasmáticos, cuantificar la intensidad antigénica por medio de los canales medios de fluorescencia y emplear múltiples marcajes para, de esta manera, detectar la coexpresión de antígenos aberrantes sobre el mismo blasto. (Al-Herz W, 2014)
Esta técnica posee una sensibilidad superior a 1 × 10-4, es decir, es capaz de detectar una célula tumoral entre 10 000 células normales. Entre sus desventajas se puede mencionar: la incapacidad para diferenciar las células normales de los blastos leucémicos en muestras que contienen un número reducido de células y que el análisis requiere necesariamente el uso de una suspensión celular, por lo que se limita el estudio fenotípico de tejidos debido al tratamiento de disgregación celular que no hace fiable la información sobre la arquitectura de los tejidos celulares, así como la interacción entre estas y el medio que las rodea. (Crestani E, 2014)
Los especímenes más utilizados en hematología, inmunología y hemoterapia para su inmunofenotipaje son variados y habitualmente incluyen: aspirados de médula ósea (MO), sangre periférica (SP) y sangre de cordón umbilical. (Crestani E, 2014)
Pueden emplearse también los productos de leucoféresis y transfusión como los concentrados de hematíes, de plaquetas y el plasma. Se estudian, además, especímenes procedentes de tejidos linfoides como ganglio linfático, bazo y timo; y de tejidos no linfoides, como por ejemplo: piel, hígado, mucosa gástrica e intestino. En este caso, pueden haberse obtenido por procedimientos quirúrgicos, biopsia o punción-aspiración con aguja fina (PAAF). (Crestani E, 2014)
De igual forma, el inmunofenotipaje se aplica para el estudio de distintos fluidos corporales, entre ellos, líquidos: cefalorraquídeo (LCR), pleural y ascítico.
Para el estudio de las LA, preferentemente se usa el aspirado de la MO por punción de la cresta ilíaca o el esternón, de modo firme y rápido, con el empleo de agujas de biopsia de 14 a 8 G, que permitan obtener un número suficiente de partículas de la MO en suspensión. Puede utilizarse también la SP cuando la cantidad de blastos exceda el 50 %. (Boldt A, 2014)
La cantidad de muestra necesaria dependerá del número de marcadores antigénicos a analizar, 1 mL de sangre total es suficiente para determinar hasta diez antígenos. (Boldt A, 2014)
Para el análisis del inmunofenotipo de las LA por CMF se recomienda usar EDTA en vez de heparina sódica, debido al uso previo del contador hematológico y para no alterar la conformación de los antígenos a estudiar. (Boldt A, 2014)
Para la determinación de antígenos de activación plaquetaria y de los productos de leucoféresis, se recomienda usar ácido citrato dextrosa (ACD) y fosfato citrato dextrosa (CPD), respectivamente. (Boldt A, 2014)
En aquellas muestras constituidas por dispersados unicelulares de tejidos sólidos; por ejemplo, de BAAF de ganglio, es conveniente que el anticoagulante esté diluido en un volumen de hasta 1 mL de un líquido isotónico estéril (suero salino fisiológico o tampón fosfato con pH 7,4) filtrado por filtros con poro < 0,40 μm. En el caso de los aspirados de la MO en los que se obtengan volúmenes inferiores a 1 mL, el volumen del líquido isotónico en el que se diluye el espécimen no debe superar el volumen de la muestra obtenida para evitar una dilución excesiva. Una vez diluido, el aspirado debe hacerse pasar repetidamente (2 o 3 veces) por una aguja de 25 G para deshacer los copos medulares. Para el estudio de la activación de plaquetas debe diluirse la muestra volumen a volumen en tampón Hepes, pH 7,4. (Finak G, 2016)
En todos los casos anteriores no se recomienda el empleo de medios de cultivo. Los especímenes obtenidos mediante biopsia o procedimientos quirúrgicos, no deben ser sometidos a procesos de fijación o congelación. Si la pieza quirúrgica es considerable (> 1 cm), es aconsejable trocearla con bisturí en piezas más pequeñas de unos pocos mm3. (Finak G, 2016)
Los métodos y períodos de conservación de las muestras obtenidas para el inmunofenotipaje pueden variar de acuerdo con el tipo de especímenes u otros productos contenidos, tipo y número de células y el estado del paciente en el momento en el que se obtuvo. (Finak G, 2016)
En general, la calidad de los resultados es inversamente proporcional al tiempo transcurrido y al grado de manipulación de la muestra desde su obtención, por lo que se recomienda el empleo de especímenes frescos, recién obtenidos.
Así, las muestras deben procesarse, fundamentalmente, en las primeras 24 h posteriores a su extracción. Para el estudio del LCR y de las plaquetas, el tiempo de conservación es aún menor, 4 h desde su obtención, ya que sus células son más susceptibles de entrar en apoptosis. (Hasan M, 2015)
En todos los casos, la muestra debe conservarse a temperatura ambiente (22-25 °C). Solo en aquellas situaciones en que la muestra no pueda procesarse en el tiempo adecuado y se requiera de tiempos de almacenamiento o transportación más prolongados, sería recomendable su conservación a temperaturas entre 4 a 6 °C y añadir reactivo estabilizador, con el objetivo de obtener resultados aceptables hasta 5 días después de su obtención, en una proporción 1/10. De esta forma, las células conservan la viabilidad requerida (> 90 %). En caso de hemólisis, grumos, microcoágulos, congelamiento visible, incorrecto llenado del tubo y mal rotulado, la muestra debe rechazarse. (Hasan M, 2015)
En otras ocasiones se realiza el lisado de los hematíes, este se puede realizar con solución lisante o cloruro de amonio, durante 10 min a temperatura ambiente. Posteriormente, las células deben ser lavadas en dos ocasiones con suero fisiológico y centrifugadas a 4 °C durante 10 min a 1500 rpm. Si la lectura en el citómetro se va a realizar dos o más horas después de haber culminado el procedimiento, las células deben ser fijadas para conservar su viabilidad con una solución fijadora (formaldehido al 1 %) y guardadas a 4 °C hasta el momento de la adquisición. (Hasan M, 2015)
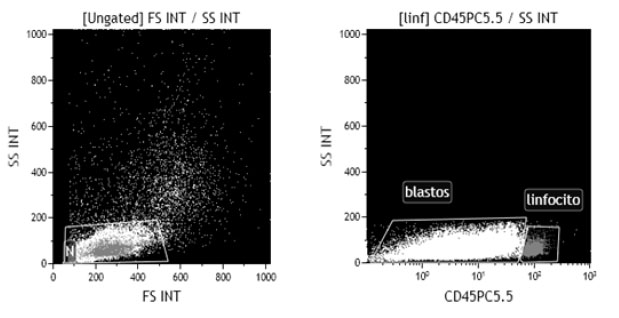
Dentro de la realización de la citometria de flujo se realiza la calibración para obtener una adecuada distribución de las células según su tamaño y complejidad interna. Estas características dependen del grado y de la magnitud de la dispersión de la luz del láser al interactuar con los componentes celulares, que se obtiene a través del análisis de la muestra que contiene solamente sangre total, la cual funciona como un control negativo. (Hasan M, 2015)
Cuando la luz difractada incide en el mismo eje de la luz incidente, se evalúa el tamaño celular a través del forward scatter (FSC). Por otro lado, cuando la luz difractada y reflejada es detectada a 90º de la dirección del láser, se evalúa la complejidad interna celular a través del side scatter (SC). (Hasan M, 2015)
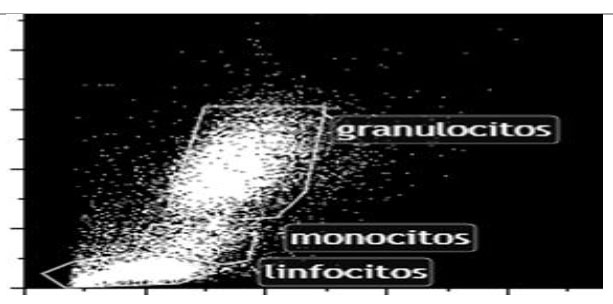
Disposición de los linfocitos monocitos y granulocitos según tamaño y complejidad
El diagnóstico inmunológico por CMF de las LA, es primordial para confirmar el diagnóstico morfológico, definir el estado de maduración celular leucémico, clasificar a la enfermedad en distintos subtipos inmunológicos, identificar subgrupos de mal pronóstico, diagnosticar LA de linaje ambiguo y detectar fenotipos aberrantes útiles para el diagnóstico de la EMR, lo cual permite estratificar a los pacientes en diferentes grupos de riesgo y de esta forma, individualizar el tratamiento antileucémico. (Farber DL, 2014)
Conclusiones
La citometria de flujo resulta de gran importancia pues permite entre otros aspectos clasificar las inmunopatias en distintos subtipos inmunológicos, así como identificar subgrupos de mal pronóstico y detectar fenotipos aberrantes. Todo lo anterior resulta de gran utilidad para el diagnóstico de la enfermedad mínima residual que permite estratificar a los pacientes en diferentes.
Bibliografía
Organización Mundial de la Salud . (2014). Estadísticas sanitarias mundiales 2014 . OMS, Geneva. Recuperado el 20 de Marzo de 2018, de http://apps.who.int/ iris/bitstream/10665/112817/1/ WHO_HIS_HSI_14.1_spa.pdf
Ahmadi A, P. A. (20 de Febrero de 2014). Diagnostic value of CD117 in differential diagnosis of acute leukemia. Tumor Bio, 35, 6763-8.
Al-Herz W, B. A. (20 de Octubre de 2014). Primary immunodeficiency diseases: an update on the classification from the International Union of Immunological Societies Expert Committee for Primary Immunodeficiency. Front Immunol, 22(5).
Biomed A, P. Z. (2014). Antigen expression pattern of acute promyelocytic leukaemia cases in Malasya. Med J Malasya, 69(2), 64-9.
Boldt A, B. S. (20 de Noviembre de 2014). Eight-color immunophenotyping of T-, B-, and NK- cell subpopulations for characterization of chronic immunodeficiencies. Cytometry B Clin Cytom, 86(3), 191-206.
Crestani E, C. S. (2014). RAG1 Mosaicismin a Patient with Omenn Syndrome. J Clin Immunol, 34(5), 551-4.
F, S.-M. (2013). La inequidad en salud afecta el desarrollo en el Perú. Rev Peru Med Exp Salud Publica, 30(4), 676-682.
Farber DL, Y. N. (2014). Human memory T cells: generation,compartmentalization and homeostasis. Nat Rev Immunol, 14(1), 24-35.
Finak G, L. M. (10 de Febrero de 2016). Standardizing Flow Cytometry Immunophenotyping Analysis from the Human Immuno Phenotyping Consortium. Sci Rep., 10(6), 20686.
Gajendra S, S. R. (15 de Septiembre de 2014). Mixed-phenotypic acute leukemia: cytochemically myeloid and phenotypically early T-cell precursor acute lymphoblastic leukemia. Blood Res, 49(3), 196-8.
Hasan M, B. B. (15 de Apr de 2015). Semi-automated and standardized cytometric procedures for multi-panel and multi-parametric whole blood immunophenotyping. Clin Immunol, 157(2), 261-76.
Institute of Health Equity . (2013). Sheridan 2011 PJN 2013. Recuperado el 20 de Junio de 2018
KE, D. (2015). Health-care worker mortality and the legacy of the Ebola epidemic, Lancet Global Health. 3(8), 439-440. Recuperado el 25 de Junio de 2018, de www.thelancet.com/journals/langlo/article/PIIS2214-109X%2815%2900065-0/fulltext
L, C. N. (2014). Global supply of health professionals. New England Journal of Medicine, 370(10), 950-957.
leukemia, B. M. (2014). Cytometry B Clin Cytom, 86, 152-3.
M, A. (2013). Working for Health Equity: The Role of Health Professionals, UCL Institute of Health Equity. Londres.
Naciones Unidas . (2016). The Millennium Development Goals Report. Recuperado el 25 de Junio de 2018, de www.un.org/millenniumgoals/2015_MDG_Report/pdf/MDG%202015%20rev%20(July%201).pd
OMS. (2008). Informe sobre la salud en el mundo 2008. La atención primaria de salud: Más necesaria que nunca. Organización Mundial de la Salud. Ginebra. Suiza. Recuperado el 12 de Febrero de 2018
Sedek L, B. A. (2014). Theimmunophenotypes of blast cells in B-cell precursor acute lymphoblastic leukemia: How different are they from their normal counterpart? Cytometry. 868, 329-39.
Yu G, V. N. (15 de Octubre de 2014). Use of flow cytometry in the diagnosis of lymphoproliferative disorders in fluid specimens. Diagn Cytopathol, 42(8), 664-70.